기존의 항암제는 세포독성 약물로서, 세포 내에 일반적으로 존재하는 DNA나 미세소관(microtubule)을 표적으로 하기 때문에 암세포에 대해서는 치료 효과를 나타내지만 정상세포에는 악영향을 끼치는 부작용을 초래합니다.
표적치료는 암이 발생하는데 핵심적인 역할을 하는 것으로 알려진 특정 유전자나 단백질, 신호전달경로를 표적으로 하여 약물을 전달함으로써 암세포를 제거하는 치료를 말합니다. 이러한 치료법은 약물이 암 조직에 효과적으로 도달하게 하여 암세포를 선택적으로 제거하고 정상세포에는 최소한의 피해를 주는 장점이 있습니다. 그러나 이들 약물은 표적이 되는 특정 유전자나 단백질을 가지고 있는 환자에게만 효과적이며, 정상세포에서의 예기치 못한 교차반응으로 인하여 부작용이 동반도리 수 있고, 선천적 혹은 후천적 약물 내성의 출현으로 인해 효과가 감소할 수 있습니다.
표적치료제는 크게 두 가지로 분류됩니다. 첫째는 세포 표면 단백질을 표적으로 하는 단클론항체(monoclonal antibody)이고, 다른 하나는 키나아제를 표적으로 하는 키나아제억제제(tyrosine kinase inhibitor)입니다.
1) 단클론항체는 암세포의 표면에 존재하는 항원에 특이적으로 부착하여 수용체의 기능을 차단하거나 수용체의 리간드(ligand, 수용체와 같은 큰 분자에 특이적으로 결합하는 물질)가 수용체에 부착하는 것을 방해하거나 수용체의 활성화를 차단합니다. 이를 통해서 종양의 성장이 억제됩니다. 일부 항체는 독성물질을 종양세포로 직접 전달하여 암세포의 파괴를 유발하기도 합니다.
B세포림프종에 사용되는 리툭시맙(rituximab), 유방암이나 위암에서 HER2 단백질을 표적으로 하는 허셉틴(trastuzumab), 결장암에서 EGF수용체를 표적으로 하는 얼비툭스(cetuximab)과 VEGF수용체를 표적으로 하는 베바시주맙(bevacizumab) 등이 흔하게 사용되는 단클론항체이며, 면역치료제도 크게 보면 백혈구를 표적으로 하는 단클론항체 치료제로 볼 수 있습니다.
2) 체내의 많은 단백질은 인산염이 부착되면 활성화되어 일을 시작하는데, 키나아제가 이 과정에서 촉매역할을 합니다. 암과 같은 질병에서 흔히 키나아제가 비정상적으로 활성화되어 있는데, 키나아제억제제는 이 효소의 작용을 일시적 혹은 영구적으로 차단하여 종양 성장을 억제하고 사멸을 유도합니다.
만성 골수성백혈병에 사용되는 글리벡(imatinib), EGFR 돌연변이가 존재하는 비소세포폐암의 치료제인 이레사(gefitinb), 타그리소(osimertinib), 렉라자(lazertinib) 등이 흔하게 사용되는 키나아제억제제입니다. 알려진 키나아제억제제는 모두 경구로 복용 가능하나, 항체는 단백질이기 때문에 경구로 복용하면 소화효소나 위산에 의해 분해될 수 있기에, 단클론항체는 정맥주사나 피하주사로 투여합니다.
환자의 면역체계가 단클론항체를 외부물질로 인식하면 이에 대하여 알레르기 반응이 나타날 수 있는데, 발열, 오한, 발진, 소양감 등이 흔한 증상이고, 심한 경우에는 호흡곤란이나 쇼크, 아나필락시스가 발생할 수도 있습니다.
정상세포의 표면에도 암세포 표면에 있는 표적과 같은 물질이 있을 수 있고, 이 경우 정상세포도 표적치료제에 의해 파괴될 수 있습니다. 예를 들어 EGFR은 정상적으로 피부나 위장관, 간 등에서도 발현되기에 EGFR 단백질에 대한 단클론항체인 얼비툭스(cetuximab)을 투여할 경우 정상적으로 피부 발진, 오심, 설사와 같은 부작용이 흔하게 나타납니다.
현재 환자분들에게 사용되는 표적치료제를 표적을 기준으로 분류하면 아래와 같습니다. 항암제의 발전속도가 매우 빨라서 더 많은 표적이 확인되고 약제들이 개발되고 있습니다. 이러한 표적치료제들은 단독으로 사용되기도 하고, 세포독성 항암제나 호르몬 수용체억제제 또는 면역치료제와 함께 사용하기도 합니다. 또한 같은 약제라도 적응증에 따라 투여용량이 다를 수 있습니다.
상피세포 성장인자 수용체(EGFR)는 체내의 여러 조직과 기관에서 발견되며, 다양한 성장인자와 반응합니다. 결장암, 폐암 등의 세포 표면에는 EGFR이 과도하게 발현되어 있는 경우가 많고, 비소세포폐암 환자의 약 30%에서 EGFR 돌연변이가 발견됩니다.
EGFR 돌연변이 비소세포폐암 환자에서 EGFR 키나아제억제제(EGFR tyrosine kinase inhibitor)인 이레사(gefitinb), 타세바(erlotinib), 지오트립(afatinib) 등이 표준치료로 사용되고 있습니다. 이들 약제는 모두 경우 항암제이며, 5~20%에서 부작용이 동반되는데, 흔한 부작용은 피부 건조, 가려움, 구내염, 설사, 식욕부진, 오심 등입니다. 이들 약제에 내성이 생긴 경우 중 상당수 환자에서는 내성 돌연변이를 표적으로 하는 타그리소(osimertinib), 렉라자(lazertinib)를 투여하면 효과를 볼 수 있습니다. 이 약제의 흔한 부작용은 설사, 구내염, 피부 건조, 발진, 손발톱 주위 염증, 혈구수 감소(골수 억제) 등입니다.
EGFR에 대한 단클론항체인 얼비툭스(cetuximab)는 전이성 대장/직장암 환자에서 항암제와 병용하여 사용했을 때 효과를 보여, 기존 항암치료에 진행한 EGFR 양성 전이성 대장/직장암 환자에서 이리노테칸(irinotecan)과 함께 사용되고 있습니다. 얼비툭스의 흔한 부작용으로는 피부의 여드름성 발진, 피로, 발열, 오한, 오심, 설사, 알레르기 반응, 탈모 등이 있습니다.
HER2는 상피세포 성장인자 수용체 중 하나로, 유방암과 위암의 약 10~30%에서 HER2 유전자 이상이 있고, 암세포 표면에 HER2 단백질이 과다 발현되어 있으며, 이것이 암의 발생이나 진행에 중요한 역할을 합니다. HER2를 표적으로 하는 단클론항체인 허셉틴(trastuzumab)은 HER2에 결합하여 HER2의 활성을 억제합니다. HER2를 과발현하는 전이성 위암에서 허셉틴과 항암제의 병용이 좋은 효과를 보이고 있으며, HER2가 과발현된 진행성 혹은 전이성 유방암에서는 또 다른 HER2에 대한 단클론항체인 퍼제타(pertuzumab)와 허셉틴을 항암제와 병용하여 사용 시 매우 효과적입니다. 허셉틴의 흔한 부작용에는 오한, 발열, 부종 등이 있으며, 허셉틴을 사용한 환자의 20% 정도에서 심장독성이 보고되고 있어 심장 기능에 대한 평가가 필요합니다. 퍼제타의 흔한 부작용에는 혈구수 감소(골수 억제), 설사, 식욕감퇴 등이 있습니다.
HER2의 표적치료제 중에는 허셉틴에 세포독성 항암제를 부착하여 항체가 HER2와 결합하면 항암제를 암세포로 전달하는 방식의 치료제도 있습니다. 이를 항체-약물 접합제(antibody-drug conjugate)라고 하는데, 약물이 암세포에만 선택적으로 작용하게 되어 부작용은 적고 높은 효과를 기대할 수 있습니다. 캐싸일라(trastuzumab emtansine)나 엔허투(trastuzumab deruxtecan)가 그 예로, 허셉틴에 내성이 생긴 유방암 환자에서 기존 치료보다 좋은 반응이 확인되었습니다. 허셉틴 내성 위암환자에서도 엔허투는 좋은 효과를 보인 바 있습니다. 이들 약제의 흔한 부작용은 피로, 근골격 통증, 간효소 수치 상승, 혈구수 감소(골수 억제), 탈모 등입니다. 엔허투 투여 환자의 10~15%에서 간질성 폐질환/폐렴 발생 위험이 있어 주의가 필요합니다.
ALK는 성장인자 수용체의 하나로, 일부 비소세포폐암이나 림프종에서 ALK 유전자의 재배열(rearrangement) 또는 융합(fusion)이 발견되며, 이는 ALK를 활성화시켜 종양의 증식과 생존을 촉진합니다. ALK 양성 비소세포폐암에서 잴리코(crizotinib), 알레센자(alectinib), 알룬브릭(brigatinib) 등이 1차 치료로 사용되고 있으며, 알레센자와 알룬브릭은 뇌전이를 동반한 경우에도 좋은 효과를 보여줍니다. 이들 약제의 흔한 부작용으로는 오심, 구토, 설사, 간효소 수치 상승, 피로 등이 있습니다.
암세포가 성장하고 증식하려면 산소와 영양분이 필요하며, 이를 위해 암세포는 VEGF(혈관내피세포 성장인자, vascular endothelial growth factor), FGF(섬유아세포 성장인자, fibroblast growth factor)와 같은 성장인자를 분비하여 신생혈관을 생성합니다. 즉 신생혈관의 형성은 종양의 성장과 전이에 있어서 필수적이고, 종양의 성장과 전이를 억제하기 위해 신생혈관의 형성을 억제하는 표적치료제들이 개발되었습니다.
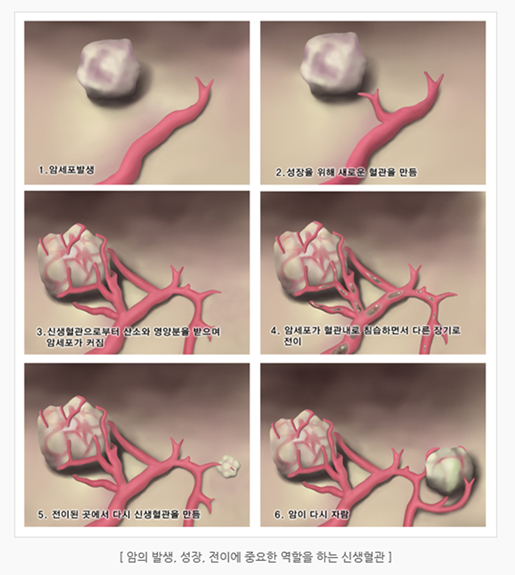
VEGF는 강력한 혈관형성인자로 VEGF가 혈관내피 표면에 있는 VEGF 수용체에 결합하게 되면 티로신 키나아제(tyrosine kinase)가 활성화되면서 신생혈관들이 생성되어 종양의 성장 및 전이에 중요한 역할을 하게 됩니다. 대부분의 혈관형성억제제가 VEGF를 표적으로 합니다. 아바스틴(bevacizumab)은 VEGF의 수용체에 대한 단클론항체로서, VEGF에 결합하여 VEGF가 VEGF 수용체에 결합하는 것을 억제함으로써 신생혈관 형성을 억제하는 작용을 합니다. 이 약제는 전이성 대장암의 1차 치료에서 항암제와 함께 사용되고 있습니다. 부작용으로는 드물지만 위장관 천공, 출혈, 혈전증, 고혈압, 단백뇨 등이 나타날 수 있으므로 사용 시 주의를 요합니다.
멀티키나아제 억제제는 여러 가지 키나아제를 동시에 억제할 수 있는 약제로, 선택적으로 키나아제 억제제보다 더 많은 신호전달체계에 영향을 미칠 수 있으나 그로 인해 더 많은 부작용을 나타날 수 있습니다. 대부분의 멀티키나아제 억제제는 표적으로 혈관형성인자를 포함하여 혈관형성을 억제하는 효과가 있습니다. 이러한 약제들은 특히 투명세포 신세포암(신장암)과 간세포암(간암) 등에서 효과적입니다.
수텐(sunitinib)과 보트리엔트(pazopanib)는 VEGFR(혈관내피세포 성장인자 수용체)와 PDGFR(혈소판 유래 성장인자 수용체)의 티로신 키나아제 수용체 억제제입니다. 수텐은 진행성 신세포암과 위장관간질종양의 치료에, 보트리엔트는 진행성 신세포암과 연조직 육종의 치료에 사용됩니다. 이들 약제의 흔한 부작용에는 피로감, 오심, 구토, 미각 변화, 피부색 변화 등이 있고, 특징적으로 수족증후군, 피부발진이 나타날 수 있으며, 보트리엔트를 복용할 경우 고혈압이 발생할 가능성이 높습니다.
넥사바(sorafenib)은 VEGFR, PDGFR 외에도 B-RAF, FLT3, RET 등 다양한 표적에 작용하는 수용체 억제제로 다양한 경로로 종양세포 증식을 억제합니다. 진행된 간세포암, 신세포암, 갑상선암 등의 치료에 사용되며, 흔한 부작용으로 피부발진, 피로감, 수족증후군 등이 있습니다.
렌비마(lenvatinib)는 VEGFR, PDGFR, FGFR(섬유아세포 성장인자 수용체), KIT, RET 등 다양한 표적에 작용하는 수용체 억제제로, 역시 진행된 간세포암, 신세포암, 갑상선암, 자궁내막암에서 사용됩니다. 흔한 부작용으로 초기에 고혈압, 단백뇨가 생길 수 있어 주의가 필요하며, 용량 감량이 필요할 수 있습니다. 다른 부작용으로는 설사, 식용감퇴, 피부발진, 관절통 등이 있습니다.
인라이타(axitinib)는 VEGFR, PDGFR, KIT 등에 대한 티로신 키나아제 수용체 억제제로 진행성 신세포암에서 단독 혹은 면역치료제인 키트루다(pembrolizumab)와 병용하여 사용됩니다. 약제의 흔한 부작용은 설사, 오심, 식욕저하, 고혈압, 피로, 수족증후군, 발진, 갑상선기능저하 등이 있습니다.
카보메틱스(cabozantinib)는 VEGFR, MET, AXL 등에 대한 수용체 억제제로 진행성 신세포암, 간세포암, 분화 갑상선암의 치료에 사용되고 있습니다. 흔한 부작용으로 고혈압, 피로, 오심, 설사, 식욕저하, 수족증후군 등이 있습니다.
만성 골수성백혈병 환자의 90% 이상은 염색체 22번과 9번의 비정상 전위에 의해 발생하며, 이 변화는 BCR-ABL1이라는 융합 유전자를 만들게 합니다. BCR-ABL 티로신 키나아제의 활동을 억제하는 물질이 BCR-ABL 양성 세포의 성장을 억제한다는 사실이 발견되었고, 이 물질이 후에 글리벡(imatinib)이라고 불리게 되는 최초의 표적치료제입니다. 글리벡과 2세대 BCR-ABL 티로신 키나아제 억제제인 스프라이셀(dasatinib), 타시그나(nilotinib) 등이 만성 골수성백혈병 치료에 이용되고 있으며, 일부 환자에서는 완전 세포유전학적 반응을 유도합니다. 또한 글리벡은 위장관간질종양(GIST, gastrointestinal stromal tumor)에서도 티로신 키나아제의 활성을 억제하여 수술이 불가능하거나 전이된 위장관간질종양의 치료에서 효과를 보여주고 있습니다.
글리벡의 주된 부작용에는 오심, 구토, 설사, 부종, 체액 저류, 관절통 등이 있으며, 스프라이셀의 부작용에는 혈구수 감소(골수 억제), 발진, 구역, 설사, 부종, 드물게 폐동맥 고혈압이 있고, 타시그나의 부작용에는 혈구수 감소, 발진, 두통, 드물게 혈전 관련 질환이 발생할 수 있습니다.
FLT3는 세포 표면에 존재하는 성장인자 수용체로 급성 골수성백혈병 환자에서 흔하게 과발현됩니다. 이 돌연변이가 백혈병 발생과 관련된 것이 잘 알려져 있으며, FLT3에 대한 억제제인 라이답(midostaurin)은 FLT3 변이가 양성인 급성 골수성백혈병 환자에서 표준 항암요법과 병용하여 사용되고 있습니다. 이 약제의 흔한 부작용에는 오심, 구토, 설사, 부종, 피로, 근골격계 통증 등이 있습니다.
세포 주기는 세포가 증식할 때 거치는 과정으로, CDK는 세포 주기의 진행을 조절하는 키나아제이며, 여러 종양에서 CDK가 과활성화되어 있습니다. 선별적으로 CDK를 억제하는 CDK4/6 억제제 입랜스(palbociclib), 키스칼리(ribociclib), 버제니오(abemaciclib)는 전이성 호르몬수용체 양성, HER2 음성인 유방암에서 호르몬치료와 병용 시 좋은 효과를 보여 1차 치료로 사용되고 있습니다. 이들 약제의 흔한 부작용에는 혈구수 감소(골수 억제), 피로, 구내염, 관절통 등이 있고, 버제니오의 경우 특히 설사가 흔히 동반됩니다.
BRCA(breast cancer gene)는 DNA 복제 과정에서 발생하는 오류를 수정하는 데에 관여하는 물질입니다. BRCA 유전자에 돌연변이가 있는 사람은 유방암과 난소암이 걸릴 가능성이 상당히 높고, 췌장암, 전립선암 등의 발생률도 높아집니다. PARP는 DNA 손상을 수리하는 단백지로 PARP 억제제를 사용하면 DNA 수리 과정이 억제됩니다. BRCA 돌연변이가 있는 암환자는 이미 DNA 수리 능력이 손상되어 있는데, 이들에게 PARP 억제제를 투여하면 DNA 손상이 너무 많이 축적되어 암세포가 사멸하는 것으로 알려져 있습니다. PARP 억제제인 린파자(olaparib)는 BRCA 변이가 있는 진행성 난소암/난관암/일차 복막암 또는 HER2 음성의 전이성 유방암 등에서 치료 효과를 보입니다. 이 약제의 흔한 부작용에는 피로, 구토, 식욕부진, 혈구수 감소(골수 억제) 등이 있습니다.
표적치료제는 기존 항암제보다 비교적 부작용이 적으며, 대상 표적이 있는 암환자에게서 표적치료 단독 혹은 기존 항암치료제와 병용하여 좋은 효과를 보여 초기 치료로 사용되고 있습니다. 그러나 이러한 효과에도 불구하고 표적치료제는 여전히 많은 한계점과 문제점을 가지고 있습니다.
첫 번째는 약물 내성입니다. 거의 모든 표적치료제는 일정 기간 이상 사용하면 새로운 유전자 돌연변이 발생, 유전자 증폭, 보조 신호경로의 활성화, 세포사멸 경로 변화 등으로 인하여 내성이 발생하며, 이는 표적치료제의 효과를 제한합니다. 이러한 내성을 극복하기 위해 치료 전략을 개선하고 새로운 치료법을 개발하는 연구가 진행 중입니다.
표적치료제도 여러 가지 부작용이나 독성을 유발할 수 있고, 이것이 장기적인 약물 투약을 어렵게 만들 수 있습니다. 이를 극복하기 위하여 암세포보다 더 특이적인 약물 개발이 진행되고 있습니다.
또한, 표적치료제는 암이 생성되는 과정에 관여하는 특정 표적인자만을 공격합니다. 따라서 같은 종류의 암이라도 특정 표적인자가 나타나는 환자에게만 효과를 나타냅니다. 그러므로 표적치료제를 보다 효과적으로 사용하기 위해서는 표적치료에 대한 효과를 미리 예측할 수 있는 예측지표를 정립하는 것이 필요합니다.
마지막으로, 표적치료제를 치료에 사용하는데 발생하는 많은 비용이 문제가 될 수 있습니다. 현재 표적치료제는 종류에 따라서 표적치료제 사용에 보험 적용이 안 되는 경우가 있으며, 보험 적용이 안 될 경우 표적치료제를 사용하는데 상당히 많은 비용이 듭니다. 그러므로 표적치료제를 사용하였을 때 효과가 높을 가능성이 있는 환자들에게 이를 선택적으로 투여해야만 불필요한 의료비의 지출을 줄일 수 있는데, 아직 그 효과를 예측할 수 있는 생물학적 지표는 충분히 확립되지 않은 상태입니다.
[위 콘텐츠는 대한종양내과학회의 참여로 제작되었습니다]
이 페이지에서 제공하는 정보에 만족하셨습니까?